离子半径大小比较(高中化学,在元素周期表中,如何比较离子半径)
化学biu一biu,让你的化学biu起来~大家好,我是小天老师,今天将给大家讲讲元素周期律和半径大小的表。元素周期律是高考考察的重要内容,学习元素周期律有利于我们掌握陌生物质的性质,本套讲义知识点讲解较为全面,适合查缺补漏和自学,需要必修二全套知识讲义的也可以私信小天老师,打印出来,学习效果更佳~
今天的知识要点有:1 元素周期律 2 半径大小的比较,最后通过几个题目巩固加深本讲知识点,一定要做完再看解析哦,如果有不清楚的地方,欢迎与小天老师交流。
要点一、元素周期律
1.元素周期律
(1)内容:
元素的性质随着原子序数的递增而呈周期性的变化。这一规律叫做元素周期律。元素性质的周期性变化是由元素原子结构的周期性变化所决定的。
(2)具体表现
①原子半径:
同周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子半径递减;
同主族中,从上到下,随着原子序数的递增,元素原子半径递增。
②化合价:
同周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;
从IVA族开始,最低负化合价递增(从-4价到-1价),第一周期除外,金属元素一般无负化合价。
元素最高价的绝对值与最低价的绝对值的和为8 。
③元素的金属性和非金属性:
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;
同一主族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减。
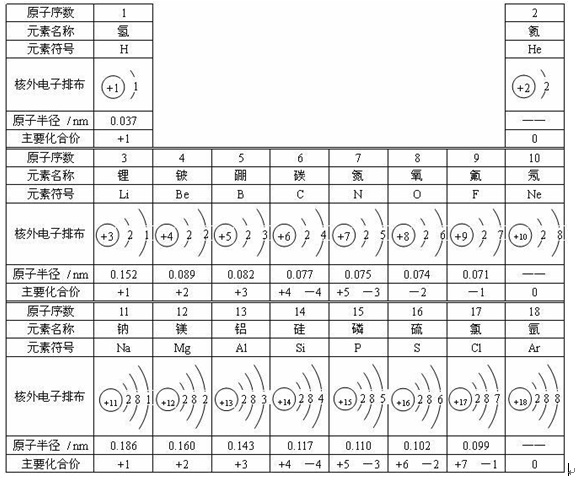
2.1—18号元素的有关知识
3.同周期、同主族元素性质的变化规律(0族除外)
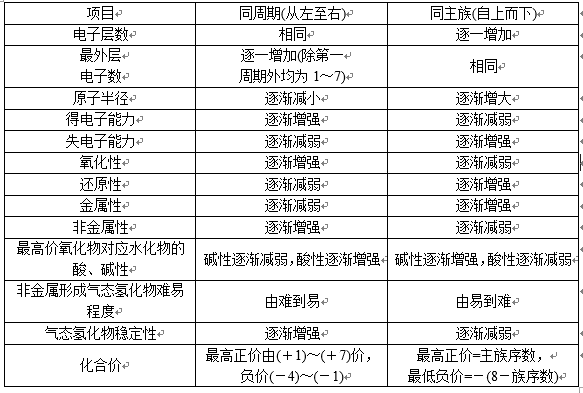
表格内容比较全面,实际上我们可以通过一幅图,两句口诀来理解
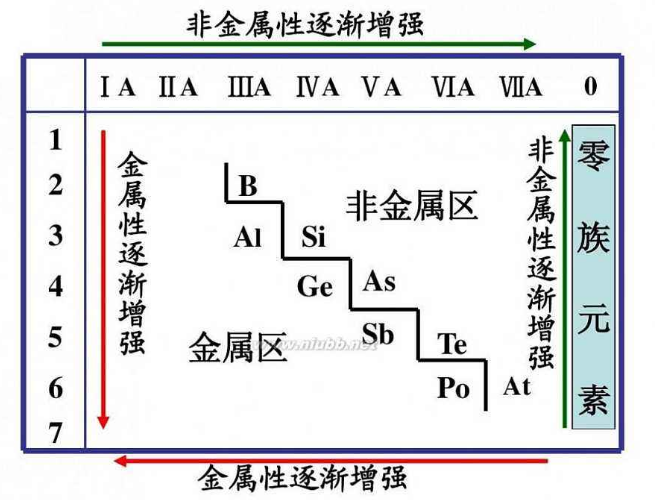
口诀:
金失还水碱离氧
含义:金属性就是失电子能力,单质的还原性,与水反应的剧烈程度,最高价氧化物水化物的碱性、离子的氧化性
非金得氧氢稳酸
含义:非金属性就是得电子能力、单质的氧化性、氢化物的稳定性,最高价氧化物水化物的酸性
4.实验探究第三周期元素的金属性、非金属性的递变规律
(1)钠、镁与水的反应
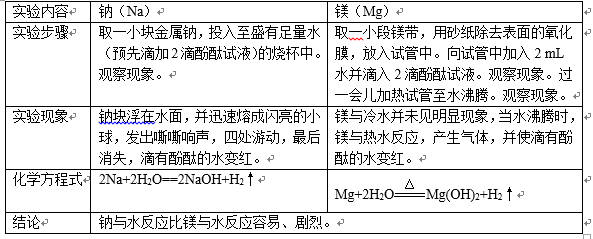
(2)镁、铝与盐酸反应
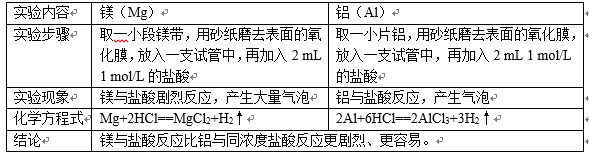
(3)钠、镁、铝的最高价氧化物对应水化物的碱性强弱为:
NaOH(强碱)>Mg(OH)2(中强碱)>Al(OH)3(两性氢氧化物)
我们可利用金属单质与水(或酸)反应的难易程度;或者金属元素最高价氧化物对应的水化物的碱性强弱比较金属元素的金属性。所以Na、Mg、Al的金属性强弱为:Na>Mg>Al。
(4)我们可利用非金属单质与氢气化合的难易程度;或者非金属元素的最高价氧化物对应水化物的酸性强弱来判断非金属元素的非金属性强弱。
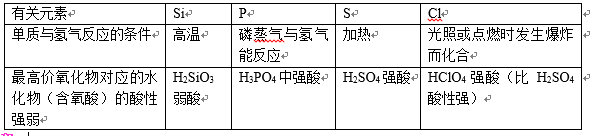
要点诠释:
①按照核电荷数递增顺序,单质与氢气化合越来越容易;
②按照核电荷数递增顺序,元素的最高价氧化物对应的水化物(含氧酸)的酸性逐渐增强。所以非金属性强弱为:Si<P<S<Cl。
③结论,在第三周期中:

要点四、粒子半径大小比较
口诀 :利用一层二核三电子进行判断

也可以理解成:层多径大,序大径小
要点诠释:
比较微粒半径大小,先看电子层数,电子层数越多半径越大;电子层数相同,再看核电荷数,核电荷数越多半径越小。
常见以下几种情况:
(1)电子层数相同的原子的半径,随核电荷数的增加逐渐减小(稀有气体除外)。如r(Na) r(Mg) r(Al)。即同周期元素的原子半径随核电荷数的增大,自左至右逐渐减小。
(2)稀有气体元素的原子半径比与它相邻的卤素原子的原子半径大。如r(Ar) r(Cl)。
(3)最外层电子数相同的元素的原子半径,随电子层数(或核电荷数)的增多而增大。如r(F)
(4)核外电子排布相同的粒子的半径,随核电荷数的增多而减小。如核外是18个电子的离子的半径大小是r(Ca2+)
(5)对同一元素来讲,价态越高半径越小。如r(Fe3+)
(6)不同周期、不同主族元素原子半径大小的比较。先找参照元素,使其建立起同周期、同主族的关系,然后进行比较。比较S与F的原子半径大小,先找O做参照,因为O与F同周期,r(F)

例1、按原子半径增大的顺序排列的一组是 ( )
A、Be、N、F B、Mg、Si、C C、Na、Mg、Ca D、Cl、S、P
【答案】D
【解析】原子半径:A项,Be>N>F ;B项,Mg>Si,Si>C;C项,Na>Mg,Ca>Mg; D项,Cl<S<P。【总结升华】原子半径的变化规律:同周期元素的原子半径随核电荷数的增大,自左至右逐渐减小;同主族元素的原子半径随电子层数的增多而增大。
例2.同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物HXO4、H2YO4、H3ZO4的酸性依次减弱,则下列判断正确的是( )
A.原子半径X最大,Z最小 B.非金属性X最强,Z最弱
C.气态氢化物中HX最不稳定 D.原子序数:Z Y X
【答案】B
【解析】由最高价氧化物对应水化物酸性强弱可知三种元素非金属性强弱顺序为X Y Z,则三种元素的原子序数大小关系为X Y Z,由同周期元素性质的递变规律可知:原子半径的大小顺序为Z Y X,气态氢化物的稳定性为HX H2Y ZH3。

这些题目你都做对了吗?如果在化学学习上遇到了困难,欢迎与小天老师交流,如果觉得有用请转发哦








